La tabla periódica de los elementos es, posiblemente, la imagen más representativa de la química. Nos acompaña desde nuestros primeros pasos durante la escuela secundaria, se convierte en objeto de estudio para quienes eligen carreras universitarias relacionadas con las ciencias exactas, naturales o de la salud, e incluso encontramos su diseño simétrico y colorido en tazas, remeras, cuadernos, y hasta en cortinas de baño.
Si bien comúnmente pensamos en la tabla periódica como un esquema estático que guarda información sobre la química de los elementos que ha sido recopilada a lo largo de la historia, la realidad es que hasta el día de la fecha existen cuestiones no resueltas en relación a su organización. Incluso, se registran posturas discordantes acerca del diseño que debería tener. Y también, más allá de los cambios controversiales que se proponen, muchos grupos de investigación trabajan para sintetizar nuevos elementos (sí, leyó bien), e incluirlos en el esquema ya conocido.
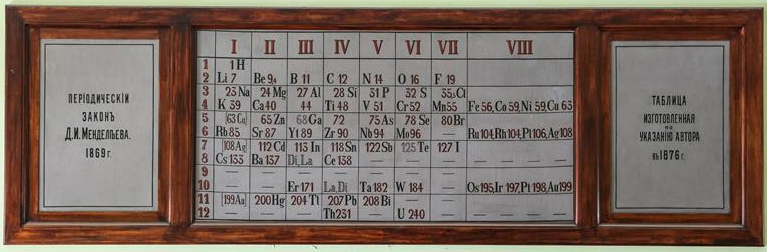
Fuente: https://www.chemistryworld.com/news/new-candidate-for-oldest-classroom-periodic-table-emerges-in-russia/3010467.article
Un desarrollo que surgió de varias cabezas
Se reconoce que el primer intento de organizar los conocimientos disponibles sobre los “elementos”, aunque no estuviera del todo claro qué eran realmente, data de 1789 con la publicación del Tratado elemental de química de Antoine Lavoisier. Allí el científico francés incluyó una “Tabla de sustancias simples”, que contenía 33 de ellas entre las que se contaban el oxígeno, el nitrógeno, el hidrógeno, el fósforo, el mercurio, el zinc y el azufre, entre otras. El trabajo realizado durante los siguientes 80 años se centró en el descubrimiento de nuevos elementos y en el avance acerca de sus propiedades (con algunos aciertos y otras tantas equivocaciones), para permitir arribar a una organización fundada en características similares o compartidas.
El 1 de marzo de 1869, Dimitri Mendeléyev le puso fecha a su primera tabla periódica y la envió a una revista científica rusa para su publicación. Él también fue el encargado de presentar su propuesta el 18 de marzo de ese mismo año en la Sociedad Química Rusa de San Petersburgo en la comunicación “La dependencia de las propiedades de los elementos químicos con su peso atómico”, que contenía su primera tabla y su ley periódica. Mendeléyev, en su modelo de tabla periódica, organizó los elementos en función de la masa atómica, es decir, del número total de protones y neutrones que conforman el núcleo de un átomo.
Si bien su propuesta encerraba algunas incongruencias respecto de la organización de ciertos elementos, que recién pudieron ser explicadas en los años posteriores con la determinación del número atómico de los mismos (es decir, del número de protones en el núcleo, concepto desconocido hasta ese momento), la organización presentada por Mendeléyev es considerada por muchos el logro más importante en la química del siglo XIX. Esto debido al carácter predictivo que tuvo, dado que dejaba espacios vacíos para elementos que, si bien aún no habían sido descubiertos, él tenía certeza de que debían existir, teniendo en cuenta las propiedades químicas de elementos cercanos ya descritos, como el emblemático caso del eka-aluminium, cuya existencia fue confirmada en 1875 y que actualmente conocemos como galio.
Sin embargo, un año antes, el químico alemán Julius Lothar Meyer ya había elaborado de manera independiente su segunda propuesta de tabla periódica, muy similar a la desarrollada por el científico ruso, con todos los agrupamientos ya conocidos: halógenos, metales alcalinos, calcógenos y así en más. Esto no se conoció en su momento porque Meyer no publicó su propuesta y, por lo tanto, solo vio la luz después de su muerte en 1895. Se especula que, quizás, las ideas de Meyer no tuvieron el impacto de las de Mendeléyev porque el científico alemán estaba más orientado a ordenar el conocimiento ya existente con fines pedagógicos que a desarrollar una ley predictiva.

Fuente: https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=9
Diseños alternativos de la tabla periódica
Si miramos la tabla periódica moderna, podemos notar que los elementos se encuentran ordenados según su número atómico en filas horizontales, llamadas períodos, y en columnas verticales, conocidas como grupos, de acuerdo con sus propiedades químicas semejantes. Sin embargo, esta disposición armónica parece no satisfacer a algunos científicos, y se han hecho propuestas más o menos conservadoras con la intención de “mejorar” la disposición de la información.
El primer ejemplo es Theodor Benfey, quien en 1960 propuso una tabla espiralada, enfatizando en la continuidad de las propiedades de los elementos al prolongar la serie de lantánidos y actínidos (bloque f) hacia afuera, en contraposición a los cortes “artificiales” impuestos en la tabla moderna.
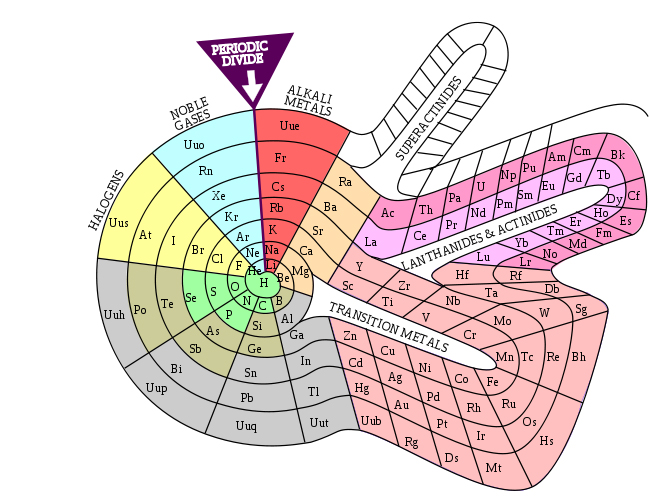
Fuente: https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=33
La siguiente alternativa parece ser algo más ornamental. El químico canadiense Fernando Dufour propuso, en la década de 1990, su modelo tridimensional de tabla periódica donde los elementos irradian desde un eje central y de forma concéntrica, ensanchándose hacia la base. La estructura se asemeja a un árbol de Navidad, donde el hidrógeno es la estrella que corona la punta. Un modelo muy práctico para que los estudiantes carguen en la mochila a la facultad.

Fuente: https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=39
Por último, Eric Scerri alienta una modificación estructural más elongada, y propone la inclusión de los elementos del bloque f entre los grupos 2 y 3, para que de esa manera la serie de número atómico se lea de forma ininterrumpida.

Fuente https://www.newscientist.com/article/mg24132190-400-three-reasons-why-the-periodic-table-needs-a-redesign/
Sea cual fuere la propuesta superadora, el foco está puesto en responder a los interrogantes que aún existen respecto de la ubicación de ciertos elementos en la tabla.
Un GPS para el hidrógeno
El caso del hidrógeno resulta llamativo. Es el elemento más abundante del universo, y su descubrimiento como tal tiene fecha en 1766 de parte del físico británico Henry Cavendish. Bastante tiempo se ha dedicado al estudio del hidrógeno y, sin embargo, en 2019 todavía quedan dudas respecto de su ubicación en la tabla periódica. El hecho es que, de acuerdo con el número de electrones de su capa externa, sería correcto incluirlo junto con los elementos del grupo 1, Na, K y amigos, dado que todos estos tienen un solo electrón en su capa de valencia.
Sin embargo, cuando consideramos sus propiedades fisicoquímicas, algo no encaja: el hidrógeno existe en estado estándar como un gas (no es un metal como los integrantes del primer grupo de la tabla). A su vez, el hecho de poder albergar hasta dos electrones en su capa externa hace que solo le falte uno para alcanzar ese estado estable. Esto lo convierte en un elemento muy reactivo, similar a lo que ocurre con los halógenos. Entonces, en términos de propiedades químicas, el hidrógeno se parece más a los elementos de grupo 17 que a los de grupo 1.
Una tercera posición posible sería por encima y entremedio del boro y el carbono, ya que posee un valor de electronegatividad intermedio, aunque para quienes tampoco se encuentren satisfechos con esta ubicación, existe la alternativa de colocarlo solo y en el centro de la tabla, pues ningún lugar es ideal.
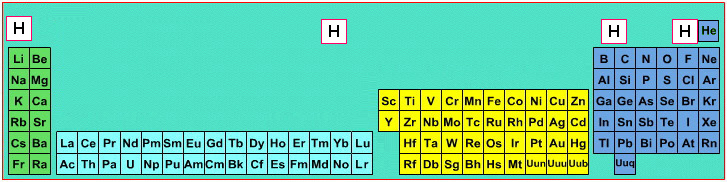
Fuente: https://www.meta-synthesis.com/webbook/35_pt/pt_database.php?PT_id=17
Un descubrimiento fallido
En mayo de 1998 una noticia desbordó de alegría los corazones de físicos, químicos y aficionados de la ciencia en general: se había descubierto el elemento más pesado hasta el momento, el elemento 118. Los responsables: el equipo de Victor Ninov, físico búlgaro con base en los laboratorios del Lawrence Berkeley National Laboratory, California. Como es habitual en la ciencia, los descubrimientos de un laboratorio terminan de validarse cuando otros científicos son capaces de replicarlo en alguna otra parte del mundo. Esto no fue posible para grupos de investigación alemanes y japoneses, lo que devino en una indagación rigurosa acerca de la veracidad del reporte de Ninov.
Para 2002, los directivos del Lawrence Berkeley admitieron la responsabilidad en un acto fraudulento de manipulación de resultados llevado a cabo por científicos de su institución al proclamarse indebidamente descubridores del elemento 118. Aunque esta mancha fue borrada de la tabla periódica cuando los científicos del Joint Institute for Nuclear Research en Rusia hallaron realmente el elemento 118, aún hoy sigue siendo tema de conversación (en la mesada de los laboratorios, en los bares, no sabemos). El físico ruso Yuri Oganessian es el único científico vivo con un elemento de la tabla nombrado en su honor, el 118 Oganesson, según anunció la International Union of Pure and Applied Chemistry, IUPAC, en 2016.
El día más importante de los últimos años
Si bien es preponderante el aporte de los físicos al campo de los nuevos elementos, sigue siendo tarea de la IUPAC validar los nombres y símbolos de los elementos descubiertos.
En 2016, el organismo anunció los nombres para los elementos 113, 115, 117 y 118 (nihonium (Nh), moscovium (Mc), tennessine (Ts) y oganesson (Og), respectivamente) y sometió a la opinión pública su decisión. La respuesta fue masiva por parte de científicos y aficionados, hasta el punto de querer elevar sugerencias al comité para modificar los nombres propuestos, lo cual no era parte de la consigna inicial.
Entre las ideas propuestas surgió, por ejemplo, la de considerar los nombres de científicos que aún no habían sido reconocidos en la tabla, como Lavoisier y Davy, entre otros. Algunos extrapolaron al campo de la química su sentido deseo de inmortalizar a los músicos recientemente fallecidos Lemmy Kilmister y David Bowie, obteniendo más de 160.000 votos a favor de la propuesta para incluir el “Lemmium” y el “Ziggium” (en honor al alias de Bowie, Ziggy Stardust) en la tabla. Sin embargo, a pesar del entusiasmo con que se recibió la participación del público en un asunto que para muchos resulta ajeno, la IUPAC debió aclarar que la potestad para elegir el nombre de un elemento químico nuevo es exclusiva de los científicos que lo han descubierto, reconociendo de esta manera el esfuerzo detrás del hallazgo.
El 119
Como se resaltó, el descubrimiento de nuevos elementos y su posterior ubicación en la tabla periódica involucra a la química y la física moderna. Aquellos elementos más pesados que el plutonio (94 protones en su núcleo) no existen naturalmente en la naturaleza ya que son muy inestables y, por lo tanto, deben ser sintetizados en el laboratorio. El caso más reciente le corresponde a los científicos japoneses del RIKEN Nishina Center, que están trabajando para obtener el elemento 119.
El experimento consistiría en disparar haces del metal vanadio (23 protones), contra un objetivo de curio (96 protones): 23+96 = 119. Parece sencillo, ¿no? Aunque nada más lejos de la realidad, pues esta reacción requiere una cantidad de energía muy precisa para que el nuevo átomo se forme, pero no se desintegre en su corta vida media y sea posible, así, constatar su existencia.
Quedamos a la espera de novedades sobre la confirmación del elemento 119 y, por qué no, del próximo llamado que realice la IUPAC a opinar (y solo eso) sobre el nombre que se le otorgue.

Dr. Timoteo Marchini. Profesor adjunto de la Cátedra de Química General e Inorgánica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Investigador asistente del CONICET, Instituto de Bioquímica y Medicina Molecular (IBIMOL).
Dr. Pablo Evelson. Profesor titular de la Cátedra de Química General e Inorgánica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Investigador independiente del CONICET, Instituto de Bioquímica y Medicina Molecular (IBIMOL).