La infección por el virus dengue (DENV) se transmite al ser humano por la picadura de mosquitos infectados de la especie Aedes (A. aegypti y A. albopictus). En las últimas décadas se verificó un aumento exponencial de casos, dando lugar a brotes más frecuentes, una tendencia que se prevé continuará, impulsada por la urbanización con altas densidades de población, la movilidad global y el cambio climático. Contrario a la creencia popular, la mayoría de las infecciones primarias son asintomáticas, por lo cual muchos individuos desconocen haber cursado la primoinfección.
CUATRO EN UNO
En 1907, pocos años después que el biólogo ruso Dimitri Ivanovsly postulara la existencia de agentes patógenos filtrables, posteriormente conocidos como virus, y que Walter Reed y colaboradores identificaran a los mosquitos como vectores de transmisión del virus de la fiebre amarilla (http://enfoco.ffyb.uba.ar/content/papers-imperdibles-un-sudafricano-con-huevos), el capitán Percy Ashburn y el primer teniente Charles Craig (Figura 1) llevaron a cabo estudios experimentales en voluntarios en los cuales demostraron que el dengue también se transmitía a través de la picadura de mosquitos. Durante el siglo XX se determinó que existían cuatro serotipos del virus, en 1943, Ren Kimura y Susumu Hotta1 aislaron el DENV-1 durante la epidemia de dengue en Nagasaki, Japón y años más tarde fueron identificados el DENV-2 en Papúa Nueva Guinea e Indonesia, y DENV-3 y DENV-4 en Filipinas y Tailandia.

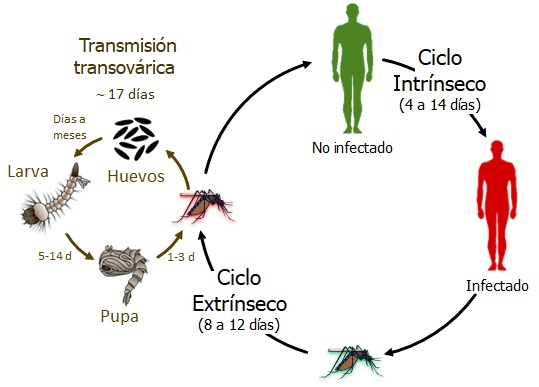
El DENV mantiene su existencia en la naturaleza a través de dos mecanismos: la transmisión horizontal entre vertebrados mediante mosquitos y la transmisión vertical (transovárica) de mosquitos infectados a su progenie (Figura 2). La trasmisión horizontal comprende un ciclo intrínseco, 4 a 14 días a partir de que un individuo es picado por un mosquito infectado y en el cual se desarrolla la viremia; y un ciclo extrínseco, 8 a 12 días desde que el mosquito pica a un individuo infectado hasta que adquiere la capacidad de transmitir la infección.
La infección por DENV suele causar fiebre, dolor de cabeza retroorbitario, mialgias, adenopatía, erupción cutánea, náuseas, dolores musculares y articulares de duración limitada (2 a 7 días), pero también puede producir dengue grave, caracterizado por dolor abdominal intenso y continuo, vómito persistente, acumulación de líquidos, sangrado de mucosas y complicaciones multiorgánicas. No obstante, la gran mayoría de las infecciones primarias por DENV son asintomáticas o subclínicas por lo cual muchos individuos desconocen haber cursado la primoinfección. Se estima que anualmente se producen 390 millones de infecciones por DENV y menos de la cuarta parte presentan manifestaciones clínicas. En las últimas décadas, la incidencia de las infecciones por el DENV ha aumentado significativamente a nivel mundial, convirtiéndose en un problema emergente para la salud pública. La mitad de la población mundial vive en zonas con riesgo de infección y, en la actualidad, se estima que el DENV causa anualmente 400 millones de infecciones y 20.000 muertes.
En la Argentina, los casos de DENV ocurren mayormente en el período estival y están estrechamente relacionados con brotes en países vecinos. Debido a la propagación del vector en el centro y norte del país, la incidencia ha aumentado en la última década. Entre 1997 y 2008, solo se notificaron unos 3.000 casos de dengue. En la temporada2 2008/09 se reportaron 27.681 casos, 75.705 en 2015/2016, 59.174 en 2019/2020, 118.089 en 2022/2023 y más de 513.205 en 2023/2024.
LOS ANTICUERPOS DE TROYA
Habitualmente, ante una infección el sistema inmune del hospedador induce una respuesta específica que lo protege de reinfectarse o al menos de padecer la enfermedad. En el caso de la infección por DENV, el problema radica en cuán específica es esa respuesta.
Como se mencionó, se han descripto cuatro serotipos genéticamente relacionados, pero antigénicamente diferentes. Cuando un individuo se infecta por primera vez con un determinado serotipo de DENV, desarrolla anticuerpos neutralizantes3 específicos contra ese serotipo (anticuerpos homólogos), que le confieren inmunidad protectiva a largo plazo contra ese serotipo. Sin embargo, la inmunidad cruzada contra otros serotipos es solo parcial y de corta duración.
La infección secundaria con un serotipo diferente a menudo se asocia con un mayor riesgo de complicaciones graves. Uno de los principales factores para este fenómeno es la presencia de los anticuerpos generados en la primoinfección, que no son específicos para el serotipo de DENV presente en la infección secundaria (anticuerpos heterólogos). Este fenómeno se conoce como amplificación de la infección dependiente de anticuerpos (Figura 3). En este escenario, los anticuerpos heterólogos, no neutralizantes o subneutralizantes, se unen al virus, no lo neutralizan y contribuyen a su ingreso a las células blanco.
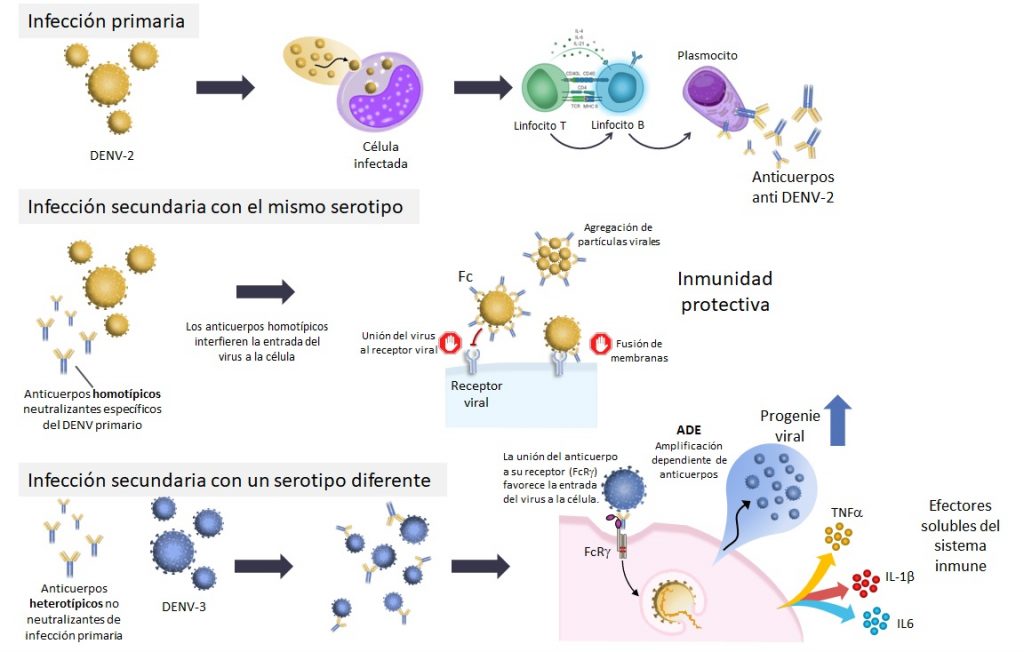
La infección primaria por DENV induce anticuerpos neutralizantes que proporcionan inmunidad protectora. En la infección secundaria con el mismo serotipo, los anticuerpos homotípícos neutralizan al virus interfiriendo su entrada a la célula afectando la unión al receptor, la fusión de membranas, o agregando las partículas virales en inmunocomplejos. En la Infección secundaria con un serotipo diferente, los anticuerpos heterotípicos formados a partir de la infección primaria se unen al virus, no lo neutralizan y contribuyen a su ingreso a las células blanco. Los receptores celulares Fcγ en las células susceptibles a DENV (monocitos por ejemplo), reconocen los complejos virus-anticuerpo heterólogo a través de la porción Fc de la inmunoglobulina y favorecen un aumento en la proporción de células infectadas, lo que conlleva a un aumento en la producción de nuevos viriones. Este fenómeno se conoce como amplificación de la infección dependiente de anticuerpos (ADE). Además, se liberan mediadores solubles no específicos del sistema inmune como IL-6, IL-1b o TNFα, que contribuyen a la alteración de las uniones estrechas de las células endoteliales, favoreciendo la extravasación plasmática, asociada a la severidad de la enfermedad y la progresión a sus formas más graves.
Los complejos virus-anticuerpo heterólogo se unen a células que expresan el receptor Fcγ, como monocitos, macrófagos y células dendríticas, que son las principales células blanco del virus, incrementando así la cantidad de células infectadas y la liberación de mediadores solubles del sistema inmune, como interleuquinas 6 (IL6), 1b (IL-1b) o el factor de necrosis tumoral (TNFα), que contribuyen a la alteración de las uniones estrechas de las células endoteliales, favoreciendo la extravasación plasmática, la cual se halla estrechamente relacionada a la severidad de la enfermedad y la progresión a sus formas más graves.
El primero en describir este fenómeno fue Royle Hawkes de la Universidad Nacional de Australia en 1964, cuando observó que la infectividad de ciertos arbovirus (ARthropod-BOrne VIRUS) aumentaba en presencia de antisueros que contenían anticuerpos inespecíficos. Estos estudios preliminares se mantuvieron olvidados durante una década, hasta que Scott Halstead y colaboradores describieron en 1977 que la replicación del DENV en cultivos celulares y en primates no humanos se incrementaba más de 100 veces en presencia de anticuerpos heterotípicos.
VACUNARSE O NO VACUNARSE, ESA ES LA CUESTIÓN
Los primeros intentos para desarrollar una vacuna contra el DENV comenzaron en la década de 1920, pero se vieron obstaculizados por la necesidad de generar inmunidad protectiva contra los cuatro serotipos del DENV.
En el último lustro, se desarrollaron y licenciaron dos vacunas atenuadas quiméricas tetravalentes. De momento, la más promisoria consiste en una cepa atenuada de DENV-2 y tres quimeras en las cuales se sustituyeron los genes de la premembrana y de la envoltura de la estructura principal del DENV-2 por los correspondientes de cada uno de los otros serotipos. En la Argentina, la vacuna fue aprobada por ANMAT en 2023 para su aplicación en personas de 4 a 60 años. El esquema de vacunación comprende dos dosis administradas con 3 meses de diferencia.
Antes de vacunarse, hay dos escenarios posibles: que nunca se haya padecido una infección por DENV y, por ende, no se posean anticuerpos contra ningún serotipo (seronegativo), o que previamente se haya infectado, ya sea en forma sintomática o asintomática, y por ende los anticuerpos estarán presentes (seropositivo).
Los estudios de eficacia y seguridad a largo plazo de un ensayo de fase 3, aleatorizado, doble ciego y controlado con placebo, compararon el riesgo de infección y de hospitalización entre quienes recibieron la vacuna o el placebo. Luego de 5 años de iniciado el protocolo, se observó una reducción del 61,2 % en el riesgo de infección y del 84,1 % de hospitalización. La eficacia de la vacuna para prevenir la infección y hospitalización varió según el estado serológico previo a la vacunación, con una mayor eficacia en personas con un estado serológico seropositivo inicial (61,4 y 85,6 %) en comparación con las personas con un estado serológico seronegativo inicial (52,6 y 79,5 %).
La vacuna, junto con medidas proactivas para reducir la población de vectores mediante la eliminación de los sitios de reproducción, la instalación de mosquiteros y la utilización de agentes químicos o biológicos, contribuirán a mitigar esta amenaza para la salud mundial.
Mercedes Elizalde es licenciada en Ciencias Biológicas por la Universidad Nacional de Mar del Plata, doctora de la Universidad de Buenos Aires, área Farmacia y Bioquímica; ayudante de segunda de la Cátedra de Virología de la Facultad de Farmacia y Bioquímica UBA e investigadora asistente del CONICET.
Diego Flichman es bioquímico y doctor de la UBA, profesor adjunto de la Cátedra de Virología de la Facultad de Farmacia y Bioquímica e investigador principal del CONICET.
- El doctor Hotta continuó visitando Nagasaki cada verano para continuar con su investigación hasta 1945, cuando el servicio de trenes a Nagasaki se suspendió porque la vía férrea que conducía a la ciudad había sido gravemente dañada por las bombas de las Fuerzas Aliadas. En consecuencia, Hotta se quedó a regañadientes en su casa de Kioto. Esta decisión le salvó la vida porque en la Facultad de Medicina de la Universidad de Nagasaki, tres profesores que habían estado investigando el dengue y los casos hemorrágicos de dengue murieron instantáneamente cuando la bomba atómica cayó sobre Nagasaki. ↩︎
- Temporada: se consideran los casos desde la semana 31 de un año a la semana 30 del año siguiente. ↩︎
- No todos los anticuerpos que se unen a un microorganismo patógeno son neutralizantes. Los anticuerpos no neutralizantes, o anticuerpos de unión, se unen específicamente al patógeno, pero no interfieren con su infectividad. Los anticuerpos no neutralizantes pueden ser importantes para “marcar” al patógeno y favorecer su degradación mediada por células del sistema inmune. Por otro lado, los anticuerpos neutralizantes pueden neutralizar al patógeno sin la participación del componente celular del sistema inmune. ↩︎