Del 18 al 24 de noviembre se celebró la Semana Mundial de la Concientización sobre la Resistencia a los Antimicrobianos dado que representa una amenaza actual y a largo plazo sobre la salud humana y animal, la producción de alimentos y el desarrollo mundial, por lo que resulta necesaria una respuesta global. Es vital realizar un seguimiento cuidadoso del desarrollo y la propagación de la resistencia a cualquier agente nuevo y, por lo tanto, un enfoque adicional en las prácticas de administración adecuadas resulta fundamental para maximizar la eficacia y la longevidad de cualquier agente nuevo que ingrese a la práctica clínica.
Todos estamos familiarizados con los “antibióticos” (más correctamente, antimicrobianos), porque seguramente en algún momento de nuestra vida hemos necesitado usar alguno. Por supuesto, si lo hemos hecho de manera correcta, será tema para otra oportunidad. Sin embargo, los antibióticos son fármacos que se utilizan en la comunidad desde hace relativamente poco tiempo. Se puede decir que existe un “antes y un después de Fleming”.
Antes, cuando no se utilizaban los antibióticos, el único método que había probado disminuir el riesgo de diseminar enfermedades infecciosas era el lavado de manos y otras prácticas de higiene asociadas, gracias a las contribuciones del obstetra húngaro Ignaz Semmelweis en el siglo XIX. Se estaba en la “era pre-antibiótica”, como se indica en la figura a continuación.
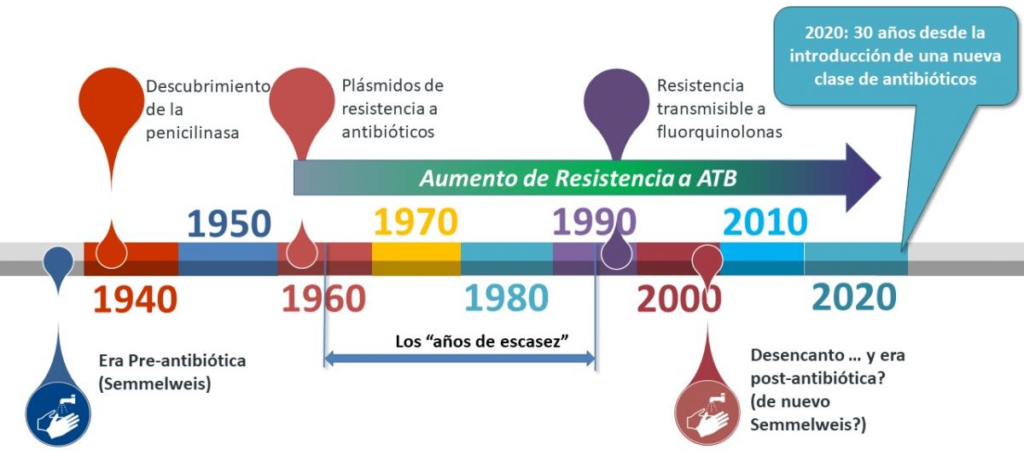
Descubrimiento de los antibióticos hasta el presente, y su asociación con la emergencia de los mecanismos de resistencia a antibióticos.
La penicilina fue descubierta de manera fortuita en 1928, cuando Alexander Fleming observó que, en una placa olvidada donde había cultivado un estafilococo, se había desarrollado también una colonia de un hongo contaminante (del género Penicillium) que producía “algo” que había “borrado” las colonias de la bacteria. Ese “algo” resultó ser por supuesto la penicilina, que (por diversos motivos) recién pudo comenzar a ser utilizada masivamente a mediados de la década de 1940, luego de una prueba exitosa que salvó la vida a varios heridos por quemaduras severas cuando se incendió el local bailable Cocoanut Grove de Boston en 1942. Hoy en día, los antibióticos de la familia de los β-lactámicos (entre los que se encuentra la penicilina) representan casi el 70 % del mercado mundial de drogas antimicrobianas frente a patógenos gram negativos como Escherichia coli o Klebsiella pneumoniae, muy por encima del resto de los antimicrobianos.
Resistencia a antimicrobianos: si no se actúa hoy, no habrá cura mañana
A partir del descubrimiento de la penicilina, comienzan los “años dorados” de los antibióticos, sobre todo en las décadas de 1950-1960, en los cuales se descubrieron la mayoría de los antibióticos que se usan hoy en día. Sin embargo, y como se aprecia en la figura de arriba, al poco tiempo de introducir cada nuevo antibiótico al mercado, y ayudado por su uso excesivo y exagerado, los mecanismos de resistencia comenzaban a ser descubiertos… Así, se detectaba la primera enzima capaz de destruir la penicilina, llamada en ese momento “penicilinasa”, que no era ni más ni menos que una β-lactamasa, ¡y hoy se conocen más de 7.000 diferentes según la base de datos “β-lactamasedatabase” (http://bldb.eu/)! Luego, en la década de 1960, se describió la primera plataforma genética móvil (un plásmido) que permitía diseminar los mecanismos de resistencia entre diferentes bacterias. Y así con cada nuevo antibiótico o clase de antibióticos…
Desde ese momento, el aumento creciente de los niveles de resistencia en bacterias patógenas, concomitantemente con la disminución en la eficacia de los antibióticos disponibles, llevó a un desinterés de muchas compañías farmacéuticas para invertir grandes cantidades de dinero en la búsqueda, el desarrollo y la producción de antibióticos, llevando a una etapa conocida como los “años de escasez”, con sólo un puñado de nuevos antibióticos introducidos en el vademécum durante los siguientes 20 o 30 años. Estos fueron años de “vacas flacas”, con el punto más bajo del descubrimiento y desarrollo de nuevos antibióticos.
Como otras veces en la historia, las bacterias resistentes ganaban otra “batalla”. Para no dar definitivamente por perdida la “guerra”, los investigadores diversificaron las estrategias de búsqueda de posibles nuevos antibióticos, que incluyeron estudios farmacológicos, bioquímicos y genómicos, especialmente con el advenimiento de las técnicas de secuenciación génica de alto rendimiento (high-throughput)y la creciente disponibilidad de herramientas bioinformáticas para análisis in silico, que permitió predecir nuevas dianas y evaluar posibles moléculas químicas que interactúan con esos blancos, acelerando enormemente el proceso de “screening” de potenciales nuevos compuestos (antibióticos, en este caso).
Como se mencionó, los antibióticos β-lactámicos representan casi un 70 % del mercado mundial de drogas antimicrobianas frente a patógenos gram negativos, muy por encima del resto de los antimicrobianos. Sin embargo, su efectividad se ha visto comprometida, principalmente debido a la diseminación de genes codificantes de β-lactamasas, sobre todo de las que resultan en altos niveles de resistencia a drogas de último recurso como los carbapenemes, cefalosporinas de quinta generación y combinaciones de β-lactámicos con inhibidores como avibactam. Esta situación se ha visto acrecentada durante la pandemia de COVID donde casi un 90 % de los pacientes internados fueron tratados con antibióticos debido a las infecciones bacterianas asociadas.
La resistencia a los antimicrobianos representa una amenaza actual y a largo plazo sobre la salud humana y animal, la producción de alimentos y el desarrollo mundial
Esto resalta la necesidad urgente de estudiar las formas en que las bacterias desarrollan resistencia a los antibióticos para alertar al sistema de salud sobre las amenazas emergentes de resistencia y ayudar en el diseño de nuevas drogas eficaces. De hecho, tan importante es hoy en día el problema de la resistencia antimicrobiana, que en 2011 la Organización Mundial de la Salud (OMS) declaró el lema “Antimicrobial Resistance: no action today, no cure tomorrow”, que se podría traducir como “Resistencia a antimicrobianos: si no se actúa hoy, no habrá cura mañana”. Luego, en la Asamblea General de las Naciones Unidas reunida en septiembre de 2016, el secretario general, Ban Ki-Moon, declaró que la resistencia a los antimicrobianos representa una amenaza actual y a largo plazo sobre la salud humana y animal, la producción de alimentos y el desarrollo mundial, por lo que resulta necesaria una respuesta global de todos los Estados miembros.
Los recientes reportes de resistencia a ceftazidima/avibactam después de pocos años de uso clínico evidencia que es vital realizar un seguimiento cuidadoso del desarrollo y la propagación de la resistencia a cualquier agente nuevo
Por su parte, a comienzos de 2014, el Ministerio de Salud de la Argentina convocó a representantes de diferentes organismos, universidades y sociedades científicas para elaborar una estrategia de control de la resistencia a los antimicrobianos, que fue aprobada por resolución oficial (Res 391/2015. Boletín Oficial, 29/615), en la que se creó la Comisión Nacional para el Control de la Resistencia Antimicrobiana (CONACRA), cuya misión es vigilar el cumplimiento de la estrategia, además de proponer y actualizar las medidas de control.
A pesar de la complicada situación planteada por los microorganismos multirresistentes y la ineficacia de algunos antibióticos para combatir muchas de las infecciones ocasionadas por estas cepas, existen nuevas opciones prometedoras.
Una de ellas, de reciente desarrollo, es el cefiderocol, que es una molécula considerada la primera cefalosporina sideróforo (que mostramos en la figura de abajo), con potente actividad antimicrobiana sobre bacterias resistentes a carbapenemes. Se trata de una molécula que es en realidad un conjugado, que incluye una porción de dos cefalosporinas diferentes, ceftazidima y cefepime (cefalosporina de tercera y cuarta generación, respectivamente), y un núcleo sideróforo. Así, la porción “cefalosporina” ejerce su efecto inhibitorio sobre la síntesis del peptidoglicano (como cualquier β-lactámico), mientras que el sideróforo facilita el ingreso de la molécula a las células bacterianas mediante los transportadores activos de hierro, en lugar de los canales (porinas) que normalmente utilizan muchos antibióticos. De esta manera, el cefiderocol puede acceder a las bacterias “camuflándose” de posibles mecanismos de resistencia, por lo cual ha sido considerado como una especie de “caballo de Troya”. Aunque, debido a que se trata de una “mezcla” de porciones de diferentes moléculas, se lo podría considerar también como una “hidra de Lerna”…
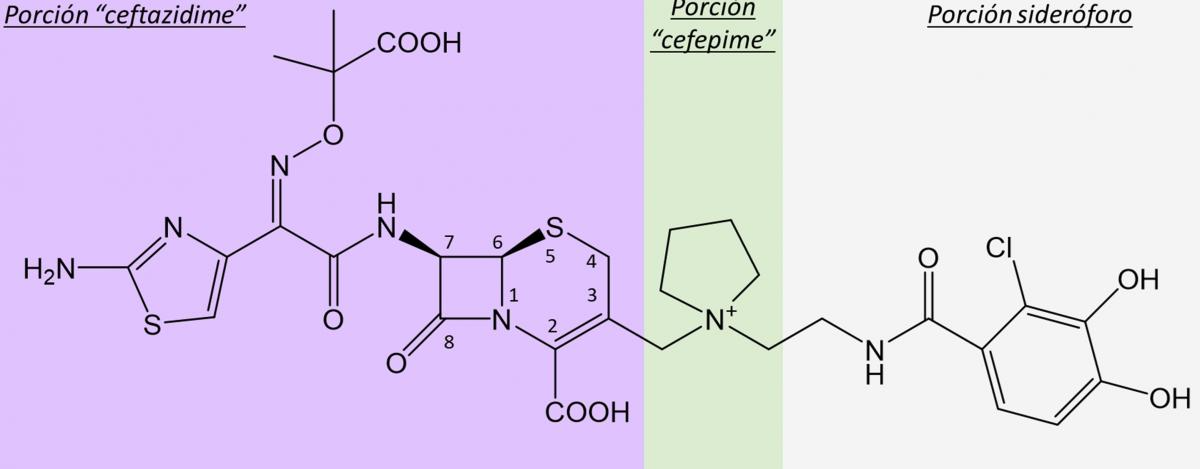
Molécula del cefiderocol, donde se muestran los núcleos “cefalosporina” (ceftazidima-cefepime) y “sideróforo”.
Los recientes avances en el desarrollo de antibióticos para su uso contra muchos de los patógenos nosocomiales multirresistentes brindan esperanza al sistema sanitario. El desarrollo de nuevos fármacos con actividad antimicrobiana, a pesar de una relativa inactividad ante la creciente resistencia, es bastante prometedora para ofrecer alternativas útiles al arsenal de antibióticos, como el cefiderocol, las combinaciones ceftazidima/avibactamo meropenem/vaborbactam, entre otros, que se espera puedan funcionar eficientemente incluso frente a patógenos complicados como Acinetobacter spp.
El tratamiento de los microorganismos productores de metalo-β-lactamasas sigue siendo más problemático, ya que su mecanismo de acción involucra la presencia de átomos de zinc, y los agentes quelantes de metales no son aplicables in vivo, por la presencia de enzimas dependientes de cofactores metálicos se encuentran también en algunas células humanas.
La gran mayoría de los antibióticos en desarrollo son el resultado de modificaciones o un “reciclaje” de agentes existentes. Sigue habiendo una falta de agentes de nuevas clases de antibióticos que inhiban nuevos blancos celulares que no estén asociados a mecanismos de resistencia preexistentes. Más aún, en el contexto de la multirresistencia causada por mecanismos distintos de las β-lactamasas, las nuevas opciones de tratamiento son incluso más escasas. Y también hay que considerar que el acceso a nuevos agentes farmacológicos puede verse limitado por cuestiones de costo, especialmente en entornos de escasos recursos o con políticas sanitarias más restrictivas.
Los recientes reportes de resistencia a ceftazidima/avibactam después de pocos años de uso clínico evidencia que es vital realizar un seguimiento cuidadoso del desarrollo y la propagación de la resistencia a cualquier agente nuevo y, por lo tanto, un enfoque adicional en las prácticas de administración adecuadas resulta fundamental para maximizar la eficacia y la longevidad de cualquier agente nuevo que ingrese a la práctica clínica. Asimismo, se requiere intensificar la implementación de técnicas de diagnóstico rápido que permitan la terapia dirigida, lo cual no sólo puede conducir a mejores resultados terapéuticos para los pacientes, sino que también puede ayudar a preservar la utilidad de los agentes antiguos y nuevos.
Bibliografía
Bush, K. and P.A. Bradford, beta-Lactams and beta-Lactamase Inhibitors: An Overview. Cold Spring Harb Perspect Med, 2016. 6(8).
Bonomo, R.A., beta-Lactamases: A Focus on Current Challenges. Cold Spring Harb Perspect Med, 2017. 7(1).
Gutkind, G.O., et al., b-Lactamase-mediated resistance: a biochemical, epidemiological and genetic overview. Curr. Pharm. Des., 2013. 19(2): p. 164-208.
Tillotson, G.S., Trojan Horse Antibiotics-A Novel Way to Circumvent Gram-Negative Bacterial Resistance? Infect Dis (Auckl), 2016. 9: p. 45-52.
Bonomo, R.A., Cefiderocol: A Novel Siderophore Cephalosporin Defeating Carbapenem-resistant Pathogens. Clin Infect Dis, 2019. 69(Suppl 7): p. S519-S520.
Meini, M.R., L.I. Llarrull, and A.J. Vila, Evolution of Metallo-beta-lactamases: Trends Revealed by Natural Diversity and in vitro Evolution. Antibiotics (Basel), 2014. 3(3): p. 285-316.
Alsenani, T.A., et al., Structural Characterization of the D179N and D179Y Variants of KPC-2 beta-Lactamase: Omega-Loop Destabilization as a Mechanism of Resistance to Ceftazidime-Avibactam. Antimicrob Agents Chemother, 2022. 66(4): p. e0241421.

Pablo Power es bioquímico por la Facultad de Farmacia y Bioquímica (FFyB) y doctor por la Universidad de Buenos Aires, profesor adjunto de Microbiología en la FFyB e investigador independiente del CONICET.