La matriz extracelular modula la proliferación, la diferenciación y la migración celular en diversos procesos fisiopatológicos. Esta matriz consiste en una red extremadamente compleja de proteínas y otras moléculas que rodean, sostienen y dan estructura a las células y tejidos. Así también, contribuye a que las células se unan y se comuniquen con otras células cercanas, y desempeña una función importante en su reproducción, su movimiento y otras funciones celulares. Además, es clave en la reparación de los tejidos dañados. Todo esto, en situaciones de normalidad.
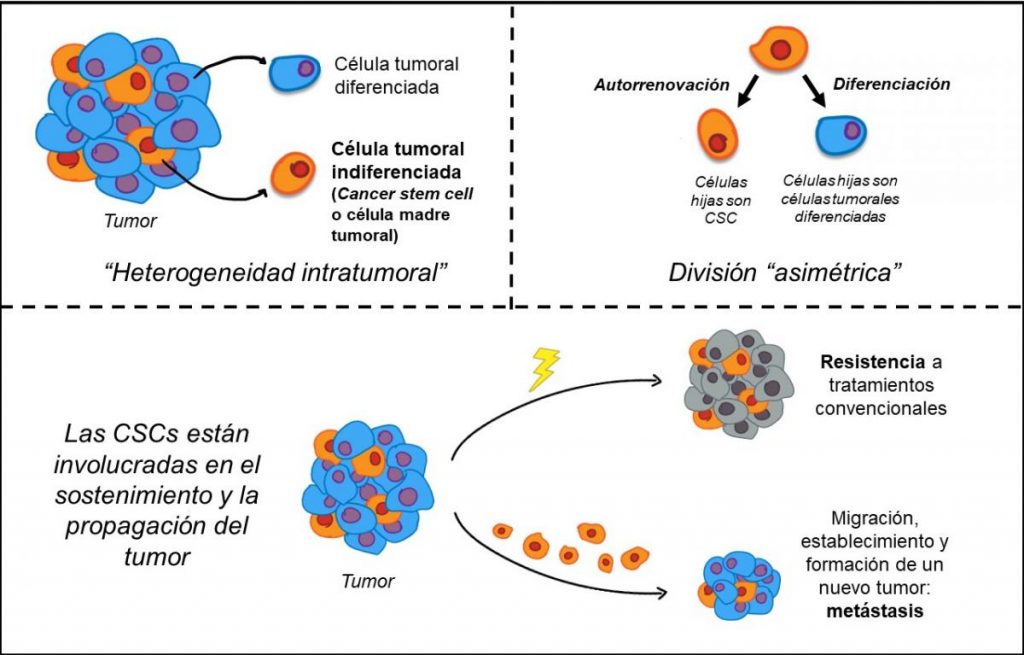
Ahora bien, los cambios cualitativos y cuantitativos en los constituyentes de la matriz extracelular se asocian a ciertas enfermedades, como el cáncer. Y, en ese caso, la matriz extracelular de las células cancerosas afecta la forma en que estas se multiplican y se diseminan. En el cáncer, las células tumorales indiferenciadas, las células madre tumorales (cáncer stem cells, CSCs, por sus siglas en inglés) constituyen una población celular relacionada con la iniciación, la progresión tumoral y la diseminación metastásica.
En los últimos años se ha reportado que un pequeño número de células con características de células madre fueron observadas en distintos tipos de tumores, y muy especialmente en el cáncer de mama. Por eso, las células madre tumorales han cobrado un creciente interés, dado, como ya se ha dicho, que se les atribuye la capacidad de originar, mantener y expandir tumores, así como de dar lugar a las metástasis y recidivas.
Por otro lado, y para mayor gravedad, estas células han demostrado ser más resistentes a tratamientos convencionales utilizados en oncología, como la quimioterapia o la radioterapia; por tanto, su presencia es un indicador de mal pronóstico. Consecuentemente, la caracterización molecular de estas células se ha convertido en uno de los campos más activos en la investigación científica, puesto que si se lograra disminuir las propiedades invasivas de estas células, se podría abordar el tratamiento de tumores malignos.
Desde FFyB En Foco hemos invitado a la doctora Graciela Calabrese, y a sus becarios doctorales por la Universidad de Buenos Aires, Ariadna Birocco y Agustín Blachman a que nos compartan sus experiencias de investigación.
Si bien las CSCs son una pequeña proporción de células dentro del tumor, son capaces de originarlo, mantenerlo y expandirlo, tienen potestad de autorrenovarse, de sobrevivir en el torrente sanguíneo, e incluso de resistir a los tratamientos oncológicos, tanto a la radioterapia como a la quimioterapia. ¿Podrían explicárnoslo de modo sencillo?
Las células madre son células indiferenciadas, vitales para la regeneración y reparación de los órganos y tejidos normales, en un entorno controlado. Una de sus principales características es su elevada proliferación o autorrenovación, con lo cual se aseguran mantener una reserva de ellas mismas; y, por otro lado, generar células especializadas o diferenciadas de un tipo celular particular. Debido a estas propiedades, las células madre se utilizan en el tratamiento de enfermedades como la diabetes y algunos trastornos neurodegenerativos. Sin embargo, el estudio de la relación entre estas células indiferenciadas y el inicio de algunas leucemias cambió la manera de explicar el inicio y la propagación del cáncer.
Actualmente, la vinculación de las células madre tumorales con el inicio, la propagación y la metástasis del tumor tiene un amplio consenso entre los investigadores de la biología del cáncer. No todas las células que integran la masa de un tumor son iguales, esto se denomina heterogeneidad intratumoral. Una pequeña población dentro de la masa tumoral son las células tumorales indiferenciadas (CSCs), a las que, como ya dijimos, también se llama “células madre del cáncer”. Estas tienen una gran capacidad para autorrenovarse, resistir a los tratamientos oncológicos y diferenciarse a otros tipos celulares en el tumor. Este grupo pequeño de células, al igual que el resto de las células tumorales, resulta de la acumulación de mutaciones que alteran su comportamiento normal. Pero, la capacidad de las CSCs de permanecer en estado latente, agazapadas, frente a las agresiones que resultan de los tratamientos oncológicos convencionales, las convierte en blancos de interés para el desarrollo de nuevas estrategias terapéuticas.
El estudio más detallado de la biología de estas células implicaría nuevos tratamientos focalizados en su eliminación para evitar la resistencia a drogas por parte de los tumores y la metástasis. ¿Podrían explayarse respecto de este tema?
La metástasis consiste en la migración de algunas células del tumor hacia sitios distantes del organismo, y su posterior establecimiento, para formar así un nuevo tumor, o tumor secundario. Es responsable del 90% de las muertes en pacientes con cáncer y, particularmente en el cáncer de mama. Entonces, la aparición de un tumor secundario es sinónimo de mal pronóstico: menos del 30% de estos pacientes sobrevive. Como se considera que las CSCs son un actor clave en el proceso de diseminación metastásica, el estudio de la biología celular y molecular de las CSCs abre la puerta a nuevos tratamientos dirigidos selectivamente a esta estirpe celular. Por ejemplo, conocer la interacción y la comunicación que se establece entre las CSCs en el cáncer de mama y su entorno, posibilita el diseño de nuevas estrategias terapéuticas para evitar su migración y diseminación.
Ustedes han planteado que la matriz, parte fundamental del nicho tumoral, interactúa con las CSCs a través de su receptor de superficie CD44. ¿Podrían explicárnoslo?
La progresión del tumor no sólo depende de las células cancerosas. Además necesita de un “nicho” o microambiente permisivo. En este entorno, las células cancerosas se encuentran en íntimo contacto con otras células no tumorales, como las que forman los vasos sanguíneos. Por otra parte, este nicho tumoral cuenta con un componente acelular único: la matriz extracelular tumoral, un andamiaje dinámico donde las células del tumor se anclan. Este soporte arquitectónico registra los cambios producidos en el entorno celular y los traduce modulando las señales que controlan la multiplicación y supervivencia, así como la adhesión y la diseminación de las células tumorales.
La recepción e integración de una amplia variedad de señales que reciben las células desde su microambiente determina su destino celular. El receptor CD44, uno de los marcadores de superficie expresados por las CSCs, desempeña un rol crítico en la comunicación de esta subpoblación celular tumoral con su “nicho”. La interacción del receptor CD44 con ligandos del microambiente tumoral no solo regula el mantenimiento del estado indiferenciado de estas células sino que, además, promueve la migración y la metástasis. Las características bioquímicas de la matriz extracelular producida por las propias células del tumor determinan un mejor anclaje y, consecuentemente, una menor probabilidad de metástasis. En contrapartida, una menor adhesión de las CSCs favorece la diseminación tumoral.
Mucho se ha avanzado en el estudio de la matriz extracelular de diferentes tumores, pero poco se conoce del entorno de las CSCs, particularmente de la matriz extracelular que limita a las CSCs del cáncer de mama.
Los nanosistemas con que ustedes trabajaron constituyen una nueva plataforma de distribución de fármacos, a través de la interacción selectiva del dermatán sulfato de la formulación con el receptor CD44. En un ejercicio de divulgación, ¿podrían relatarnos este proceso? Y, en particular, ¿qué es el dermatán sulfato y cómo actúa o podría actuar?
Nuestro grupo de trabajo ha diseñado y obtenido un nanotransportador selectivo de fármacos. Para dimensionar a este vehículo de distribución, recordemos que un nanómetro equivale a una mil millonésima parte de un metro. Este transportador está formado a partir de dos compuestos naturales: el quitosano, que se obtiene a partir de exoesqueletos de crustáceos; y el dermatán sulfato, aislado a partir de la mucosa intestinal bovina. Pero además, transporta a un pequeño péptido sintético con propiedades antiinflamatorias, copiado a partir de un tripéptido presente en la clara del huevo de gallina.
El dermatán sulfato es un hidrato de carbono complejo, del grupo de los glicosaminoglicanos, que se encuentra en la matriz extracelular de los mamíferos. Su presencia en el nanotransportador permite que este sea reconocido por las células humanas que son capaces de interaccionar con la matriz extracelular a través de proteínas en su superficie.
De esta manera, a través del dermatán sulfato, el nanotransportador es capaz de unirse al marcador de superficie CD44. Esto le permite distribuir el péptido antiinflamatorio solo a las células que muestran ese receptor. Como el CD44 es uno de los marcadores de las CSCs en los tumores de mama, este nanotransportador podría distribuir fármacos dirigidos selectivamente a esta estirpe celular.
“Buscamos establecer las características del nicho de las CSCs en el cáncer de mama, con el objeto de identificar microRNAs para ser distribuidos selectivamente por la nanoformulación y lograr inhibir la migración e invasión de esta estirpe celular”, han postulado ustedes…
Sí, disponer de esta plataforma de distribución, que sería capaz de alcanzar las CSCs dentro de los tumores de mama, plantea un desafío estratégico: “cargar” a las partículas con algún compuesto que sea capaz de afectar a las CSCs. Debido a la intrínseca relación entre las CSCs y la matriz extracelular, nuestro objetivo es cargar a los nanotransportadores con un compuesto que genere una alteración en la relación CSCs-matriz: buscamos así disminuir las propiedades migratorias de las CSCs, para evitar que se diseminen por el organismo. Para eso, la estrategia es usar microRNAs: un microRNA es una molécula de ARN capaz de silenciar la expresión de una o varias proteínas. Como este mecanismo de acción es propio de las células, la carga de los nanotransportadores con una molécula de este tipo es una estrategia terapéutica prometedora, que se diferencia de las terapias convencionales basadas en drogas sintéticas, ya que toma los propios procesos de las células y los vuelve en su contra.
Para terminar, ¿cómo creen que este proyecto puede contribuir al desarrollo de terapias para el cáncer de mama?
En la actualidad, los tratamientos convencionales para el cáncer de mama se enfocan en la destrucción de todas las células del tumor, sin importar su estirpe. Sin embargo, estas terapias son mucho menos efectivas en tumores invasivos que han hecho metástasis. Desarrollar una estrategia orientada a las CSCs, que son resistentes a los tratamientos clásicos, permitirá prevenir la formación de masas tumorales distantes. Creemos que estos nanotransportadores tienen el potencial de distribuir drogas a las CSCs, y consideramos que alterar la manera en la que la célula y la matriz extracelular se relacionan podría ser una estrategia prometedora para disminuir la movilidad de las células y así generar una alternativa terapéutica para los pacientes con este tipo de cáncer.
Entrevista: Centro de Divulgación Científica, Facultad de Farmacia y Bioquímica, UBA

Ariadna M. Birocco es bioquímica (FFyB, UBA), realiza sus estudios de doctorado en el Laboratorio de Matriz Extracelular y es ayudante de primera en la Cátedra de Biología Celular y Molecular.
Agustín Blachman es bioquímico (FFyB, UBA), realiza estudios de doctorado en el Laboratorio de Matriz Extracelular y de maestría en Ciencias Biomédicas (IMBS, UBA-Universidad Albert Ludwigs, Freiburg, Alemania) y es ayudante de primera en la Cátedra de Biología Celular y Molecular.