La búsqueda de estrategias relativamente sencillas de aplicar, y de bajo costo, para purificar proteínas de alto valor, ya sea comercial o terapéutico, constituye un desafío permanente para quienes diseñan procesos biotecnológicos. Investigadores del Instituto de Nanobiotecnología (NANOBIOTEC), de la Facultad de Farmacia y Bioquímica, UBA, y el CONICET, hallaron que miniesferas de quitosano, un polímero natural obtenido a partir de la quitina, podrían convertirse en un candidato crucial para “pescar” proteínas presentes en mezclas realmente complejas de materias primas biológicas.
La quitina es un biopolímero lineal y, mundialmente, es el segundo polímero natural en abundancia después de la celulosa. Se encuentra principalmente en el exoesqueleto de crustáceos (como cangrejos y langostinos), y de muchos insectos (como cucarachas y escarabajos). A su vez, y gracias a la magia de la Química, la quitina se puede “transformar” en quitosano sin perder la “esencia” polimérica. De este modo, tanto la quitina como el quitosano presentan muchas aplicaciones industriales y comparten propiedades muy atractivas: se puede disponer de ellos en grandes cantidades, son biocompatibles, son biodegradables y ecológicamente seguros. Además, son baratos y no tóxicos.
La cromatografía es una técnica de separación ampliamente conocida, de gran aplicación industrial, y gracias a la cual los componentes de una muestra compleja se pueden aislar en forma selectiva cuando se “hacen pasar” a través de una matriz o fase estacionaria determinada. El objetivo de esta última fase es, entonces, retrasar, retener o “pescar” aquellos componentes de la muestra original que son de interés. Terminado el paso en el que la muestra corre a través de la fase estacionaria, la molécula objetivo se puede “despegar” utilizando diferentes métodos.
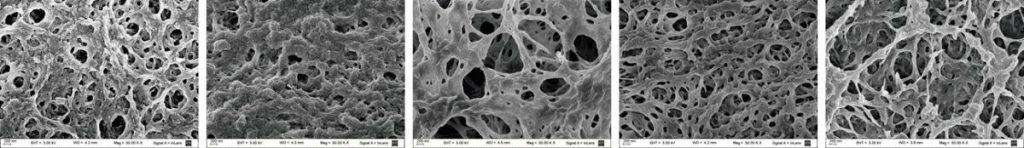
La quitina y el quitosano se pueden elegir como material de partida para obtener fases estacionarias cromatográficas, especialmente para el procesamiento posterior de proteínas. “Jugando con el pH, la solubilidad y reactivos químicos especiales, se pueden generar soportes cromatográficos para aplicaciones industriales concretas y de bajo costo en forma de miniesferas de quitosano”, asegura el doctor Federico Wolman, quien está a cargo de la investigación en la Cátedra de Biotecnología de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. “Además, dada la estructura química del quitosano, es posible modificarlo y acondicionarlo para facilitar la adsorción e inmovilización de diferentes proteínas de una forma muy eficiente”, agrega. “Por último estas matrices de bajo costo podrían incubarse directamente con la muestra de partida, incluso en presencia de material particulado, sin necesidad de recurrir a ningún tratamiento previo”, concluye.
Pescador del Paraná
Podemos imaginar lo que ocurre durante el proceso cromatográfico entero como si fuéramos a pescar al río Paraná. Para empezar, en el interior de sus aguas se esconden una enorme variedad de especies de peces (corvinas, surubíes, sábalos, dorados, patíes, tarariras, salmones de río, etc.). Además, supongamos que cada una de ellas requiere de anzuelos diferentes: la pesca será más exitosa en la medida que utilicemos anzuelos más específicos. Por último, una vez acabada la jornada, estamos en condiciones de contar la cantidad de peces de cada especie y concluir acerca de la especificidad del anzuelo seleccionado. En este sencillo ejemplo, el río representaría la muestra compleja de partida –que, además de la molécula de interés, contiene otras tantas especies– y los pescadores con sus cañas y anzuelos serían la matriz o fase estacionaria. El proceso de colectar los peces en un recipiente y recuperar el anzuelo sería equivalente a lo que los especialistas denominan elución.
La metáfora del pez chico y del pez grande
Las glicoproteínas son moléculas compuestas por una estructura o “esqueleto” proteico unido a uno o varios restos más pequeños de azúcares. Estas maravillosas construcciones de la naturaleza juegan un papel esencial en muchos procesos biológicos específicos, incluyendo la defensa inmunológica, la fertilización, la replicación viral, la infección parasitaria, el crecimiento celular, la inflamación y la adhesión celular. Dicho de otro modo, el mundo de las glicoproteínas puede imaginarse variopinto, lleno de matices, en donde pequeñas variaciones en cualquier parte de la molécula podrían conducir a una modificación profunda de su función. De manera que, para quienes desarrollan métodos de purificación de biomoléculas, el aislamiento de glicoproteínas no es tan sencillo como tirar la caña y esperar el pique.
Es verdad: las miniesferas de quitosano se pueden utilizar directamente como matriz cromatográfica para la purificación de proteínas. De hecho, este es el caso de la aglutinina de germen de trigo, que aunque tenga un nombre un poco raro, es una lectina ampliamente conocida por quienes llevan a cabo experimentos de investigación básica con glicoproteínas dada su capacidad para interactuar con ciertos azúcares. Pero ¿qué podría ocurrir si, en vez de basar la pesca en el anzuelo, utilizamos un pez pequeño como carnada para atrapar al gran pez? Es decir ¿es posible anclar una glicoproteína determinada usando la aglutinina de germen de trigo originalmente atrapada en la matriz de quitosano? En efecto, esta es la estrategia que investiga, propone y explota el doctor Federico Wolman junto a su equipo de trabajo para purificar biomoléculas tales como el glicomacropéptido (partiendo de suero de queso) y la gonadotrofina coriónica equina (partiendo de plasma de yeguas preñadas), con potencial comercial en el campo alimenticio y veterinario, respectivamente. Asimismo, modificando químicamente la superficie del quitosano con ciertos colorantes textiles y partiendo de suero de leche, es posible purificar otras glicoproteínas con interesantes aplicaciones como la lactoferrina y la lactoperoxidasa.
Lo simple, barato y bueno, triplemente bueno
El doctor Wolman confiesa que, al principio, la idea de trabajar con miniesferas de quitosano no lo sedujo en absoluto. “A mí me gustaban las matrices cromatográficas sofisticadas, cuyo funcionamiento se podía explicar solo a partir de conceptos ingenieriles complicados. Por el contrario, las miniesferas me parecían muy simples para que funcionaran”. “Con el tiempo –aduce– pude comprender la versatilidad y el potencial de este material, especialmente cuando se parte de muestras crudas complejas que no se pueden tratar eficientemente con las matrices cromatográficas convencionales.”
Además, el doctor Wolman explica que, en algunas ocasiones, en el ámbito académico se desestima el aspecto económico de los insumos requeridos industrialmente para aislar biomoléculas. “Las matrices que se utilizan tradicionalmente para purificar proteínas pueden ser, con diferencia, mucho más caras que el producto que se pretende comercializar. En este sentido, la estandarización del uso del quitosano podría significar una considerable disminución de los gastos de producción y, en consecuencia, una gran oportunidad para comercializar la proteína objetivo a un menor costo”.
En la actualidad, el equipo del doctor Wolman está fuertemente enfocado en el desarrollo de tecnologías de bajo costo para recuperar proteínas de alto valor industrial a partir de residuos o subproductos agroindustriales que, de otro modo, se descartarían al medio ambiente, y que con las matrices convencionales o tradicionales no podrían ser tratadas. “Somos conscientes de que el quitosano está ganando un protagonismo inesperado a nivel mundial y, en este contexto, nuestra mayor aspiración es poder abastecer tanto nacional como regionalmente con materiales e insumos para desarrollar nuevos procesos productivos”.
Diego Canseco
Farmacéutico y especialista en Biotecnología Bioquímico-Farmacéutica por la Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires (FFyB). Se formó como divulgador en el Curso de Divulgación Científica de la FFyB.
Glosario
Aglutinina de germen de trigo: es una glicoproteína compleja, presente en el trigo, y que pertenece a la superfamilia de proteínas denominadas lectinas, las que se caracterizan por interaccionar de manera selectiva con hidratos de carbono libres o asociados a otras proteínas. La aglutinina de germen de trigo es una molécula de alto valor agregado y con un mercado creciente debido a sus múltiples usos para la purificación y el estudio de glicoconjugados.
Glicomacropéptido: es un péptido que se libera al suero durante la fabricación del queso. Se puede usar como un suplemento nutricional para personas con fenilcetonuria ya que carece de aminoácidos aromáticos.
Gonadotrofina coriónica equina: es una hormona que se encuentra en el plasma de yeguas preñadas. Esta glicoproteína tiene una acción estimulante del folículo para aumentar la eficiencia reproductiva en animales de interés productivo, por lo que se usa ampliamente en los protocolos de superovulación.
Lactoferrina: es una glicoproteína que transporta hierro a través de la sangre y está presente en la leche materna y otras secreciones de mamíferos. Numerosos estudios le atribuyen diferentes propiedades como la modulación del metabolismo del hierro, la regulación del sistema inmunitario, la modulación de la inflamación y la maduración de las células intestinales. Además, presenta actividad antibiótica, anticancerígena y antioxidante.
Lactoperoxidasa: es una enzima que juega un papel importante en la protección de la glándula mamaria y el tracto intestinal de los recién nacidos contra los patógenos. También tiene la capacidad de degradar varios carcinógenos y de proteger contra efectos oxidativos dañinos.
Lectinas: son un grupo de proteínas ubicuas que comparten la propiedad de unir carbohidratos o azúcares de forma específica y reversible. Se hallan ampliamente distribuidas en la naturaleza y se han identificado en bacterias, virus, plantas, vertebrados e invertebrados. La capacidad de unir de manera específica carbohidratos hace que las lectinas posean un alto valor agregado asociado a las múltiples aplicaciones biotecnológicas en que pueden ser utilizadas.
Polímero: es una macromolécula, de alto peso molecular, que se obtiene a partir de la unión repetitiva de “ladrillos” o unidades más simples llamadas monómeros. Los biopolímeros (o polímeros naturales que forman parte de los seres vivos) pueden ser de tres tipos: proteínas, hidratos de carbono o ácidos nucleicos.

Federico Javier Wolman es bioquímico por la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. Hizo su doctorado en la Cátedra de Biotecnología-Instituto Nanobiotec (UBA-CONICET), donde se desempeña actualmente como investigador independiente. Además, es profesor adjunto en la Cátedra de Biotecnología.
Equipo de trabajo
Daniela Belén Hirsch es ingeniera en Alimentos (UADE) y está finalizando sus estudios de doctorado en la Cátedra de Biotecnología- Instituto Nanobiotec (UBA-CONICET). Es ayudante de primera en la Cátedra de Biotecnología.
María Fernanda Baieli es licenciada en Biotecnología (UNQ), especialista en Biotecnología Industrial (FCEN-INTI) e hizo su doctorado en la Cátedra de Biotecnología-Instituto Nanobiotec (UBA-CONICET), donde se desempeña actualmente como investigadora adjunta.
María Victoria Miranda es bioquímica (FFYB, UBA) e hizo su doctorado en la Cátedra de Biotecnología- Instituto Nanobiotec (UBA-CONICET), donde se desempeña actualmente como directora e investigadora principal. Es profesora titular de la Cátedra de Biotecnología.
Nicolás Urtasun es licenciado en Biología (FCEN, UBA) e hizo su doctorado en la Cátedra de Biotecnología-Instituto Nanobiotec (UBA-CONICET). Es ayudante de primera en el Departamento de Fisiología y Biología Molecular y Celular de FCEN. Es investigador adjunto en el instituto IQUIBICEN.
Osvaldo Cascone es bioquímico y farmacéutico (FFYB, UBA) e hizo su doctorado en la Cátedra de Química Biológica. Actualmente se desempeña como investigador superior del Instituto Nanobiotec. Es profesor consulto en la Cátedra de Biotecnología.








