Uno de los mayores desafíos de la farmacología actual es desarrollar terapias efectivas para el tratamiento del cáncer. Entre los distintos tipos de neoplasias, los adenocarcinomas ductales pancreáticos (PDAC), el subtipo más común de cáncer de páncreas, representa un reto particular al ser el tumor con peor pronóstico en oncología, debido principalmente a su diagnóstico tardío, su alto potencial metastásico y su elevada resistencia a terapias convencionales.
A pesar de ser poco frecuentes, los PDAC son la cuarta causa de muerte por cáncer a nivel mundial y producen aproximadamente 266.000 muertes al año. Más aún, de no revertirse las tendencias actuales y el balance entre incidencia y mortalidad de esta enfermedad se estima que será la segunda causa de muerte por cáncer para antes de 2030.
Dada esta problemática, y la falta de eficacia de las terapias convencionales actuales, resulta necesario, desde el punto de vista farmacológico, identificar nuevos blancos terapéuticos para el tratamiento de esta enfermedad.
En este contexto, las investigaciones de nuestro grupo confirmaron que la proteína de resistencia a multidrogas 4 (MRP4) se encuentra asociada al desarrollo y el mantenimiento de PDAC, y que su modulación controla la progresión de estos tumores.
La MRP4 es una proteína que se ubica en la superficie celular y se encarga de exportar fuera de la célula sustancias endógenas, como mediadores de la comunicación entre células; y sustancias exógenas, como agentes quimioterápicos.
Nuestro grupo identificó que la MRP4 también controla el transporte de AMPc, una molécula que se encuentra involucrada en numerosos mecanismos vitales al actuar como segundo mensajero, y por cuyo hallazgo en 1971 Earl Sutherland recibió el premio Nobel de Medicina (https://www.nobelprize.org/nobel_prizes/medicine/laureates/1971/presenta…).
En el Laboratorio de Farmacología de Receptores (UBA-CONICET) observamos que el bloqueo farmacológico o molecular del transporte de AMPc por la MRP4 inhibe el crecimiento de cultivos celulares de PDAC, y la formación de tumores en modelos experimentales en ratones.
La profundización de estos estudios mostró que el AMPc transportado al exterior de las células cancerígenas tiene un papel mitogénico, es decir, promueve el crecimiento de las células tumorales actuando a través de algún receptor de la superficie celular aún no identificado. Estos resultados no sólo aportan nuevos conocimientos acerca del papel del AMPc en la comunicación y la regulación del comportamiento celular, sino que plantean nuevas posibilidades terapéuticas para el tratamiento del cáncer de páncreas.
Por otra parte, estos estudios, junto con observaciones realizadas por otros laboratorios, demuestran que existe una relación entre la cantidad de MRP4 que tienen las células y el grado de malignidad de las células tumorales de PDAC.
En otras palabras, altos niveles de MRP4 podrían contribuir al desarrollo de PDAC de alto riesgo, al favorecer un estado más agresivo de las células tumorales. En relación a esto, también demostramos que así como la MRP4 controla la cantidad de AMPc dentro y fuera de la célula, el AMPc también controla la cantidad de MRP4 que tienen las células. De esta forma, existe una regulación dual entre el marcador de malignidad MRP4 y el factor mitogénico AMPc.
Estos resultados podrían explicar la mayor cantidad de MRP4 presente en los tumores de pacientes con cáncer de páncreas con respecto a la observada en páncreas normales.
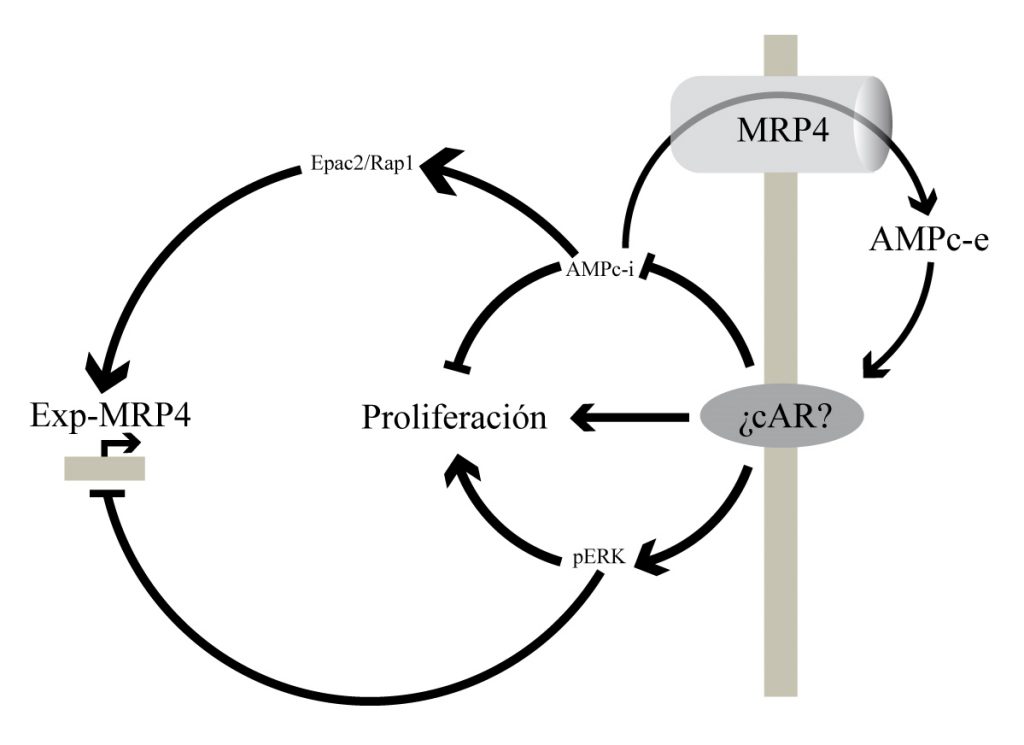
Los aumentos sostenidos en los niveles de AMPc-i se encuentran asociados a una disminución de la proliferación de las células de PDAC. A fin de limitar esta señal y volver a los niveles basales de AMPc, los mismos son regulados de forma rápida, entre otros mecanismos, por la exclusión de este segundo mensajero mediada por MRP4; y de forma lenta, por el aumento de la transcripción de este transportador y el consecuente aumento de este proceso. A su vez, como mecanismo adicional, el AMPc excluido al compartimiento extracelular actúa sobre un receptor específico aún no descripto (cAR), disminuyendo sus niveles intracelulares y activando la cascada de MEK/ERK. De esta forma, el AMPc-e, desencadena una señal mitogénica, a la vez que disminuye la expresión de MRP4, actuando, por lo tanto, como un mecanismo de retroalimentación negativa de los efectos del AMPc-i. cAR: cyclic AMP Receptor
En conclusión, nuestros estudios confirman que la proteína MRP4 representa una molécula asociada al cáncer de páncreas y su modulación controla la progresión del mismo. Estos hallazgos podrían contribuir al desarrollo de estudios de detección temprana y seguimiento terapéutico. Por otro lado, aportan evidencias acerca de un nuevo blanco para dirigir una terapia específica que controle esta enfermedad. El desarrollo de un fármaco para intervenir sobre ese blanco terapéutico es un desafío complejo.
EL DESARROLLO DE FÁRMACOS
Si bien, actualmente, estamos en la búsqueda de compuestos que sirvan para el desarrollo de fármacos, la incorporación de un nuevo medicamento en el mercado no es posible sin el apoyo de la industria farmacéutica, debido a los altos costos que esto implica. De todos modos, estamos convencidos que construyendo conocimiento sólido, como el que hemos logrado hasta el momento, podremos incorporar la participación de otros actores con el fin de introducir terapias novedosas, menos agresivas y con un costo social acorde con las necesidades de una gran parte de la población mundial que sufre este tipo de patologías.
Alejandro Carozzo. Tesis doctoral difundida: “Estudio de los mecanismos de regulación de la proteína asociada a resistencia a multidrogas 4 (MRP4) y sus implicancias en adenocarcinomas ductales pancreáticos”
Carozzo trabajó bajo la dirección de los doctores Carlos Davio y Natalia Fernández, del Instituto de Investigaciones Farmacológicas (UBA-CONICET) y de la Cátedra de Química Medicinal de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires. La tesis, defendida el 16 de septiembre de 2015, mereció la calificación de 10 – Sobresaliente, summa cum laude.
Laboratorio de Farmacología de Receptores
Instituto de Investigaciones Farmacológicas (UBA-CONICET) y Cátedra de Química Medicinal de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires.








