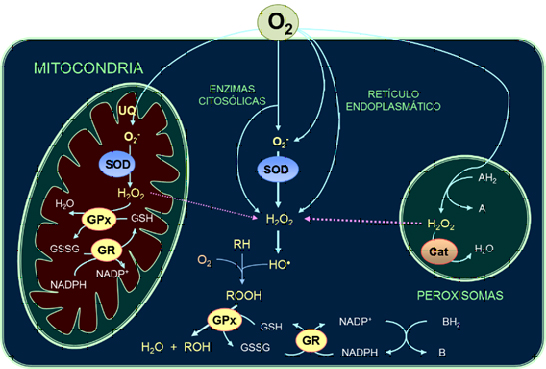
Las bases teóricas acerca de la generación y la utilización del peróxido de hidrógeno (H2O2) en células y tejidos, sumado a la determinación experimental y la cuantificación de la generación intracelular y mitocondrial de H2O2 sustentaron la revisión realizada, en 1979, por Britton Chance, Helmut Sies y Alberto Boveris (Hydroperoxide metabolism in mammalian organs, Physiol Reviews 59 (3): 527-605) en la cual se abordaron los aspectos bioquímicos, biofísicos y fisiopatológicos del metabolismo de hidroperóxidos, tanto del peróxido de hidrógeno (HOOH) como de hidroperóxidos orgánicos (ROOH), en células de mamíferos.
Previamente, en 1946, Leonor Michaelis había descripto que el oxígeno podía reducirse secuencialmente a agua, a través de cuatro etapas de transferencia de un electrón, con formación de radical superóxido (O2·-), peróxido de hidrógeno (H2O2) y radical hidroxilo (HO·) como intermediarios, y de agua como producto final. En 1954, Rebeca Gerschman postuló a los radicales libres del oxígeno como responsables de la toxicidad del oxígeno y de la radiación. Sin embargo, la reducción parcial del oxígeno en sistemas biológicos fue considerada un concepto meramente teórico. Esto se debió al descubrimiento del “fermento respiratorio” o citocromo c oxidasa-enzima que cataliza la reducción del oxígeno a agua en las mitocondrias- por Otto Warburg (Premio Nobel, 1928), vinculado a la concepción funcional, propuesta por David Keilin, que sostenía que los electrones se transfieren a través de una cadena de citocromos reduciendo al oxígeno completamente y que solo en el último paso se combina con iones de hidrógeno para formar agua. Los hallazgos de Warburg-Keilin, sumado a la falta de métodos adecuados para medir la generación de H2O2 -especie con capacidad de difundir a través de membranas biológicas- eclipsaron, durante varios años, la investigación sobre la reducción univalente de oxígeno en células de mamíferos.
El punto de partida indiscutible del conocimiento sobre el papel de los radicales libres y del H2O2 en los sistemas biológicos se debió al descubrimiento, en 1969, de la enzima superóxido dismutasa (SOD) por Joe McCord e Irwin Fridovich, la cual cataliza la dismutación del O2·-, dando como productos H2O2 y oxígeno. La existencia de la Cu,Zn-SOD en eritrocitos se hizo extensiva al citosol de otros tipos celulares. Se sostuvo “si hay una enzima, existe el sustrato”, por lo que a la presencia de la SOD se le sumó el descubrimiento de la generación de O2·- por la enzima xantina oxidasa, reconociéndose así la generación fisiológica de especies de la reducción parcial del oxígeno. Estos estudios se complementaron con el descubrimiento de la isoenzima Mn-SOD -característica de bacterias- en la matriz mitocondrial de células de mamíferos (1970-1975), y con el hallazgo de Boveris, Enrique Cadenas y Chance (1972-1976) quienes demostraron que las mitocondrias generan O2·- y H2O2 en condiciones fisiológicas.
De esta forma, la revisión de Chance et al. (1979) se centró no solo en el análisis de la generación de H2O2 sino también de su consumo, enfatizando la función de la SOD, de la catalasa (Cat) que regula la concentración intracelular de H2O2 y del sistema glutatión peroxidasa (GP) que regula la concentración de H2O2 y de hidroperóxidos orgánicos. No solo se consideró la acción de las defensas antioxidantes enzimáticas, sino que se incluyó el papel del NADPH y de los sistemas “tiol” dentro de las células .
¿En qué aspectos habían trabajado cada uno de los autores, en forma previa a esta revisión, que los llevó a realizar un análisis riguroso, integrado y coordinado de los hallazgos que había, hasta ese entonces, en el campo del metabolismo de especies activas del oxígeno y de hidroperóxidos en sistemas biológicos?
Se había podido determinar experimentalmente y cuantificar la generación del H2O2 a través del uso de técnicas espectrofotométricas, ya que la catalasa junto al H2O2 forman un compuesto intermedio I, con propiedades ópticas características, el cual había sido descubierto por Chance, en 1947. Este compuesto I, observado en bacterias vivas, fue utilizado por Sies y Chance para estimar la concentración intracelular de H2O2 en tejidos de mamíferos u órganos in situ. Por su parte, Boveris y Chance (1972-1973) estudiaron la generación mitocondrial de H2O2 y describieron que el H2O2 se produce fisiológicamente y que su producción depende de las condiciones energéticas de la célula. Esta observación marcó un cambio de paradigma al establecer que se generaba una significativa y “medible” reducción parcial del oxígeno en la “central energética” de las células aeróbicas.
Posteriormente a este hallazgo, Boveris y Cadenas (1975-1977) identificaron que el precursor estequiométrico del H2O2 mitocondrial es el radical O2·- -el reactivo de la reacción catalizada por la Mn‑SOD de la matriz de dicha organela- y que dicho radical se genera, en las mitocondrias de los órganos de los mamíferos, como consecuencia de la reacción de autoxidación no-enzimática de la ubisemiquinona, el intermediario univalente de la oxidación del ubiquinol de la cadena respiratoria mitocondrial. Al año siguiente de la publicación de esta revisión, Julio Turrens junto a Boveris (1980) describieron otra reacción que produce O2·- en la mitocondria: la autoxidación de la flavina semiquinona de la NADH‑deshidrogenasa de la cadena respiratoria.
Es de destacar que la revision de Chance, Sies y Boveris consideró tanto el papel de las especies reactivas del oxígeno en situaciones fisiológicas como en situaciones de toxicidad, sensibilidad a la radiación, fagocitosis y senescencia, abriendo el camino a la aplicación de los conceptos de producción, estados estacionarios y utilización de radicales libres y especies químicas relacionadas en condiciones fisiológicas y patológicas en los órganos de los mamíferos, y al término de estrés oxidativo (Sies, 1985). En la actualidad, los tres intermediarios de la reducción parcial del oxígeno (O2·- H2O2 y HO·) se denominan conjuntamente “ROS” (del inglés, Reactive Oxygen Species) a favor de efectos biológicos asociados por la reacción denominada Fenton/Haber-Weiss. Este concepto, si bien pierde la identificación química de las moléculas involucradas, imparte una operatividad biológica, médica y de aplicación clínica.
Aunque pasaron más de 40 años de su publicación, el análisis elegante, exhaustivo, riguroso, minucioso y crítico que hicieron los autores acerca del metabolismo del H2O2 en células y tejidos, reinterpretando datos publicados por la comunidad científica de aquel entonces, dentro de un contexto biofísico-bioquímico con aplicación biológica, fisiopatológica y en el área de salud, hace que esta revisión sea considerada uno de los pilares bibliográficos del metabolismo de H2O2 y de radicales libres en sistemas biológicos.
Britton Chance, Helmut Sies, Alberto Boveris. Hydroperoxide metabolism in mammalian organs. Physiological Reviews 59 (3): 527-605, 1979.