El fenómeno de plasticidad del desarrollo, también llamada programación, consiste en la adaptación del programa genético de un individuo expuesto a condiciones ambientales adversas. Esta adaptación involucra cambios estructurales, fisiológicos y metabólicos en diferentes órganos como el riñón, el corazón y los vasos sanguíneos, que pueden llevar a enfermedad renal o cardiovascular en la vida adulta. Dado que el riñón en desarrollo es particularmente vulnerable a diferentes tipos de eventos adversos y que la función renal es un determinante fundamental de la presión arterial, la programación renal es considerada un elemento clave para la programación de la hipertensión.
¿Qué estudiamos en nuestro laboratorio?
Desarrollamos una línea de investigación que estudia la participación de la endotelina (ET) en el desarrollo posnatal del riñón de la rata, ya que en los roedores el riñón continúa formándose durante los primeros 10 a 15 días de vida, aproximadamente. A diferencia de los roedores, en los humanos el riñón ya está formado al nacimiento; no obstante, su maduración y la adquisición de funcionalidad continúa durante el primer año o año y medio de vida. Además en los bebés prematuros el riñón puede estar inmaduro al nacer.
¿Por qué inhibimos la endotelina y cómo lo hacemos?
La endotelina es un péptido que fue descubierto, en principio, por sus propiedades vasoactivas, pero más tarde se comprobó que participa en múltiples funciones en diferentes órganos y es particularmente importante en el riñón. Además, la ET es crucial durante el desarrollo dado que se demostró que a los animales a los que les falta algún componente del sistema de ET poseen un fenotipo letal. Tanto la expresión de la ET como de sus receptores aumenta en el riñón hacia el final del período embrionario y durante el período posnatal temprano, hecho que sugiere que este sistema tiene influencia sobre el desarrollo y el crecimiento del riñón.
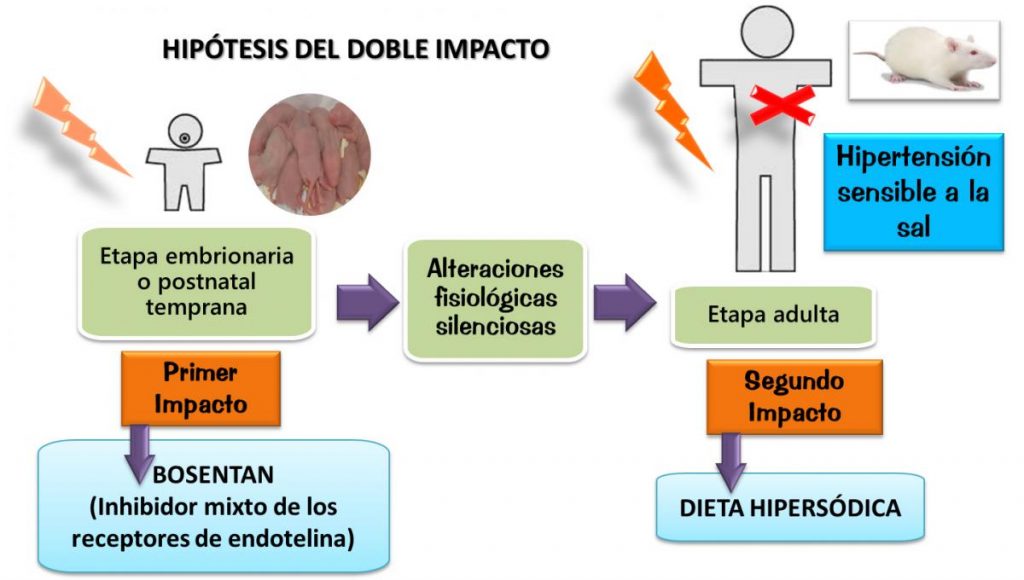
Para realizar este estudio inhibimos la ET mediante la administración por vía oral de un antagonista dual de sus receptores ETA y ETB (bosentan) durante los primeros 20 días de vida de las ratitas. Uno de los hallazgos más importantes fue que en las ratitas tratadas con el antagonista de los receptores de ET disminuyó el número total de glomérulos y el área de filtración en la zona yuxtamedular del riñón (este efecto fue de mayor magnitud en los machos en comparación con las hembras).
En 1988, Barry Brenner, del University Hospital Case Medical Center, postuló que la disminución del área de filtración asociada con una disminución del número de nefrones puede llevar a retener sodio y, en consecuencia, a hipertensión. Es así que decidimos estudiar qué efecto tenía una dieta con alto contenido de sodio en las ratitas que habían sido tratadas con el inhibidor de ET durante el período posnatal, una vez que se hacían adultas.
¿Qué resultados obtuvimos en los animales adultos?
Encontramos que sólo los machos tratados con bosentan en el período posnatal y alimentados con una dieta rica en sodio en la adultez aumentaron alrededor de 20 mm Hg su presión sistólica, es decir que se hicieron sensibles a la sal. Entre los mecanismos responsables de este efecto, hallamos que en los animales que aumentaron la presión está disminuida la capacidad de eliminar sodio y agua debido a que expresan mayor cantidad del transportador de sodio ENaC (canal epitelial de sodio) y del transportador de agua acuaporina-2 (AQP2) en las células principales del túbulo colector de la médula renal.
El aumento en el nivel de expresión de estos transportadores sería consecuencia de una menor producción de ET en la médula renal y de un aumento de la vía de vasopresina. En definitiva, la mayor expresión de estos transportadores trae como consecuencia una mayor reabsorción de sodio y agua y, concomitantemente, un aumento de la presión arterial. Estos resultados fueron enviados recientemente para su publicación.
¿Cómo continúa el proyecto?
Actualmente estudiamos los mecanismos moleculares responsables del fenotipo de sensibilidad a la sal en los animales tratados con el inhibidor de ET durante el período posnatal; tanto en los animales pequeños como en los adultos. Los mecanismos responsables de la generación de hipertensión sensible a la sal son complejos y solo se comprenden parcialmente. Se demostró que las especies reactivas del oxígeno (ROS) generadas por diversos impactos durante la vida perinatal actúan como mediadores que inician cambios epigenéticos que pueden inducir la programación de enfermedades. En este sentido, estamos evaluando el balance relativo entre la generación de ROS y la capacidad antioxidante celular y posteriormente nos abocaremos a estudiar la regulación epigenética de genes implicados en el control de la presión arterial.
¿Cuál es la potencial utilidad de los resultados de este proyecto?
Bosentan es un fármaco que se usa en la clínica principalmente para tratar la hipertensión pulmonar, por lo que puede ser administrado a neonatos e infantes. Sin embargo, no se hicieron estudios sobre el efecto que tiene su administración en neonatos e infantes cuando estos son adultos; particularmente en los humanos se podrían ver más perjudicados los bebés prematuros. Por esto, conocer los mecanismos moleculares que llevan a la programación de hipertensión sensible a la sal luego de administrar bosentan permitirá el diseño de estrategias terapéuticas de reprogramación, que en este caso es importante para evitar los efectos secundarios deletéreos de la droga, que justamente por ocurrir más tardíamente al ser desafiado el organismo con un segundo impacto (como es el caso de una dieta hipersódica) podrían no ser tenidos en cuenta.

Cátedra de Biología Celular y Molecular. Facultad de Farmacia y Bioquímica